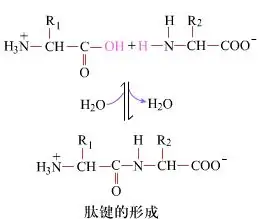
На површини, формирање пептидних веза, које дају дипептиде, је једноставан хемијски процес.То значи да су две компоненте аминокиселина повезане пептидном везом, амидном везом, док су дехидриране.
Формирање пептидне везе је активација аминокиселине у условима благих реакција.(А) карбоксилна група, друга амино киселина (Б) Нуклеофилно активирана карбоксилна група затим формира дипептид (АБ)."Ако карбоксилна компонента (А) није заштићена, формирање пептидне везе се не може контролисати."Нуспроизводи као што су линеарни и циклични пептиди могу се мешати са циљним једињењима АБ.Стога, све функционалне групе које нису укључене у формирање пептидне везе морају бити заштићене на привремено реверзибилан начин током синтезе пептида.
Дакле, синтеза пептида - формирање сваке пептидне везе - укључује три корака агрегације.
Први корак је припрема неких аминокиселина којима је потребна заштита, а цвитерјонска структура аминокиселина више не постоји.
Други корак је реакција у два корака за формирање пептидних веза, у којој се карбоксилна група Н-заштићене амино киселине прво активира до активног интермедијера, а затим се формира пептидна веза.Ова спрегнута реакција може се десити или као реакција у једном кораку или као две узастопне реакције.
Трећи корак је селективно уклањање или потпуно уклањање заштитне подлоге.Иако се сво уклањање може догодити тек након што су сви пептидни ланци састављени, селективно уклањање заштитних група је такође потребно да би се наставила синтеза пептида.
Зато што 10 аминокиселина (Сер, Тхр, Тир, Асп, Глу, Лис, Арг, Хис, Сец и Цис) садрже функционалне групе бочног ланца, које захтевају селективну заштиту, чинећи синтезу пептида компликованијом.Морају се разликовати привремене и полутрајне заштитне основе због различитих захтева за селективност.Привремене заштитне групе се користе у следећем кораку да одражавају привремену заштиту аминокиселинских или карбоксилних функционалних група.Полутрајне заштитне групе се уклањају без ометања већ формираних пептидних веза или бочних ланаца аминокиселина, понекад током синтезе.
„У идеалном случају, активација карбоксилне компоненте и накнадно формирање пептидних веза (реакције спајања) треба да буду брзе, без формирања рацемских или нуспроизвода, а моларне реактанте треба применити да би се постигли високи приноси.Нажалост, ниједна од метода хемијског спајања не задовољава ове захтеве, а неколико је погодних за практичну синтезу.
Током синтезе пептида, функционалне групе укључене у различите реакције обично су повезане са мануелним центром, глицин је једини изузетак и постоји потенцијални ризик од ротације.
Последњи корак у циклусу синтезе пептида је уклањање свих заштитних група.Селективно уклањање заштитних група је важно за продужење пептидног ланца поред захтева за потпуно уклањање заштите у синтези дипептида.Синтетичке стратегије треба пажљиво планирати.У зависности од стратешког избора, Н може селективно уклонити α-амино или карбоксилне заштитне групе.Термин „стратегија“ се односи на редослед реакција кондензације појединачних аминокиселина.Генерално, постоји разлика између постепене синтезе и кондензације фрагмената.Синтеза пептида (позната и као "конвенционална синтеза") се одвија у раствору.У већини случајева, постепено продужавање пептидног ланца може се синтетизовати само коришћењем пептидног ланца за синтезу краћих фрагмената.Да би се синтетизовали дужи пептиди, циљни молекули се морају сегментирати у одговарајуће фрагменте и утврдити да могу да минимизирају степен диференцијације на Ц крају.Након што се појединачни фрагменти постепено склапају, циљно једињење ће бити спојено.Стратегија синтезе пептида обухвата избор најбољег и најприкладнијег заштитног фрагмента, а стратегија синтезе пептида избор најпогодније комбинације заштитних база и најбоље методе коњугације фрагмената.
Време поста: 19.07.2023